Digitale Akten für Medizinprodukte
CE-Kennzeichnungen und internationale Zulassungen
MDR und IVDR verlangen der Technischen Dokumentation deutlich mehr Detailtiefe ab. Aber auch der Anspruch an ein schlüssiges Gesamtbild ist gestiegen. MEDULUS ist die smarte, digitale Lösung für Verlässlichkeit und Konsistenz in Medizinproduktakten.
Konventionelle Aktenführung nicht mehr praktikabel
Technische Dokumentation auf Basis gesammelter Textverarbeitungsdateien oder Tabellenkalkulationen werden dem wachsenden Anspruch nicht mehr gerecht. Sowohl MDR als auch IVDR sehen für das Inverkehrbringen von Medizinprodukten Risiko- und Qualitätsmanagementsysteme sowie Gebrauchstauglichkeitsanalysen verpflichtend vor. Sollte eine Software beinhaltet sein, ist der Software-Lebenszyklus abzubilden. MEDULUS kennt den Anspruch der Verordnungen und hilft digital, smart und regelkonform beim Inverkehrbringen von Medizinprodukten.
Mit MEDULUS die Zusammenhänge der Dokumente immer im Blick behalten
MEDULUS ist „die intelligente Spinne im digitalen Aktennetz“, bei MEDULUS laufen alle Fäden zusammen. Die Komplexität aus regulatorischen Anforderungen und Prozessen mit unterschiedlichen Schnittstellen ist auf konventionellem Weg nicht mehr zu beherrschen. Die Fülle an Informationen führt nicht selten dazu, dass Normen sich gegenseitig referenzieren, was die Rückverfolgbarkeit der Dokumente innerhalb der Akten zunehmend erschwert. Normenkonformität ist ohne entsprechendes Werkzeug nicht mehr sicherzustellen.
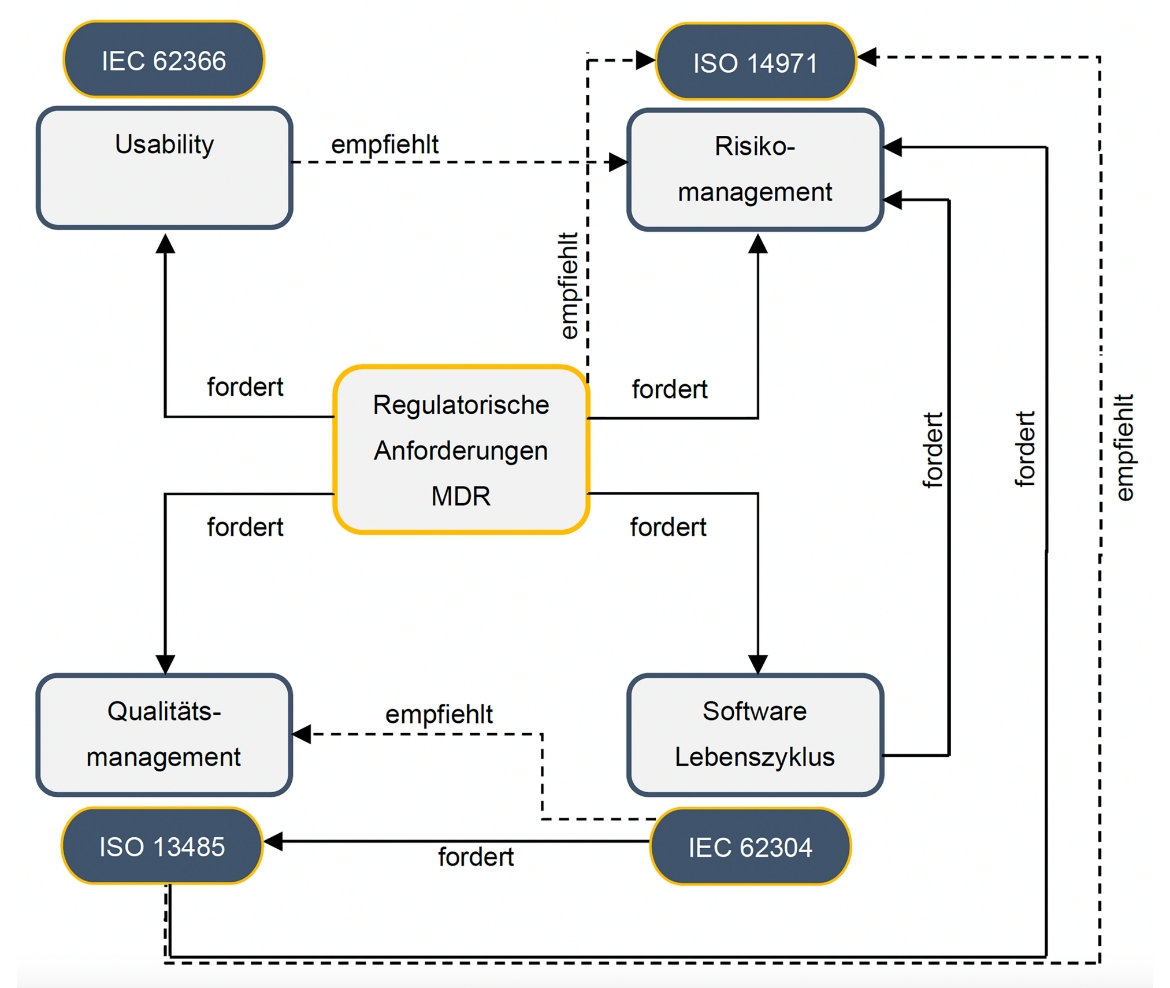
Eingebaute Normencompliance:
MEDULUS bringt harmonisierte Normen in Beziehung zur MDR.
IEC 62366 → Usability
IEC 62304 → Software Lebenszyklus
ISO 14971 → Risikomanagement
ISO 13485 → Qualitätsmanagement
Das Ergebnis.
Eine bessere Akte.
Zeit- und Kostenersparnis durch effizienteres Projektmanagement, neue Freiräume für Entwicklung und Innovation.

Einsatzmöglichkeiten: MEDULUS kennt sich aus.
MEDULUS ist immer up-to-date und kennt sich mit Normen, Standards und Leistungsanforderungen internationaler Zulassungsprozesse für Medizinprodukte aus. Compliance Garantie und Automation per Mausklick für Produktentwicklungen und Neuzulassungen von Medizinprodukten oder erforderliche Aufarbeitungen im Rahmen von MDR und IVDR.
MDR/IVDR
Die Medical Device Regulation sowie die In-Vitro Diagnostic Device Regulation fordern in der Umsetzung alle Beteiligten. Welchen Einfluss haben neueste Background Notes in der weiteren Umsetzung? MEDULUS hat den Überblick.
CE-Kennzeichnung
In Europa führt für Medizinprodukte kein Weg an der CE-Kennzeichnung vorbei. Was in Brüssel aktuell gewollt wird, weiß MEDULUS.
Produktentwicklung
Compliance, Konsistenz und Traceability bereits ab dem ersten Kapitel der Produktentwicklung. Mit der Unterstützung von MEDULUS beginnt die regelkonforme Aktenführung bereits in der Startphase der Entwicklung.
Neuzulassungen von Medizinprodukten
Mit MEDULUS gelangen neuentwickelte Medizinprodukte garantiert compliant auf den Markt. Die digitale MEDULUS Akte erfüllt alle Zulassungsanforderungen.
Aktenupdate gemäß MDR/IVDR
Mit der Importfunktion von MEDULUS können bestehende Akten effizient übernommen werden. Damit ist eine verlässliche Prüfung und das Update auf den aktuellen Stand von MDR und IVDR einfach möglich.